臺大與中研院合作解出臺灣第一個七穿膜蛋白質結構
生化科技系楊伸副教授的「結構與感光生物實驗室」傅煦媛博士和中研院副院長王惠鈞實驗室的許敏峰博士,經多年努力,終於解出了臺灣第一個七穿膜的蛋白質結構。這除了是國立臺灣大學參與解出的第一個膜蛋白質結構,也是臺灣第二個多穿膜蛋白質結構,或第三個膜蛋白質結構。
楊伸老師指出,這次解出此蛋白質,讓科學界第一次瞭解到,這種以單一光子為能量來源就能進行質子輸送,間接生產生物能的膜蛋白質,如何可以克服外界的不利環境仍進行功能。此項重大成果,在如何設計和利用這類蛋白質產生能量上,可以使產生能量的潛能提高預計達2-10倍,是此類蛋白質被發現四十年來,重大的進展。
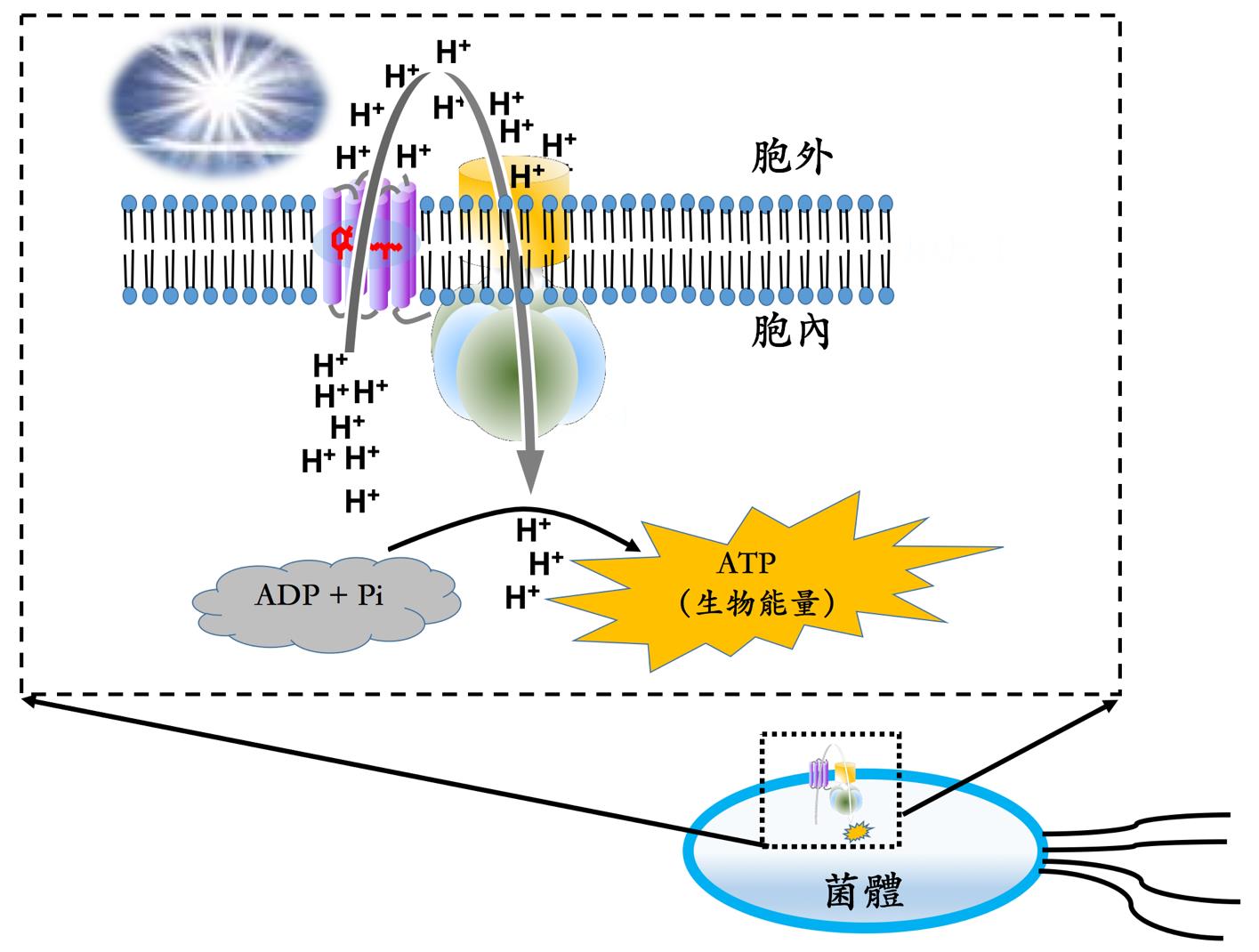
這一個紫色的蛋白質,是大自然原生設計,用來將光能轉成生物能的巧妙裝置,現仍廣泛存在於一些喜歡極端環境菌類中,包括臺灣南部的鹽田中的嗜鹽古生菌。當有適合的光照波長(550 nm),菌體就會利用此光能來驅動此一蛋白質,把胞內質子打出胞外,這些質子就會透過位於其旁的另一組蛋白質(ATP synthase),輕易地藉著濃度差,讓這些質子再度流入胞內。而在質子流入胞內的過程中,每三個質子就能促進一個 ATP高能分子的合成,就像是推磨一般,非常有效率,也令人讚嘆。於是利用這類蛋白質,菌體可以高枕無憂地邊享受陽光,邊源源不絕產生 ATP 。這類的感光蛋白質,叫菌型視紫蛋白質(Bacteriorhodopsin, BR)。
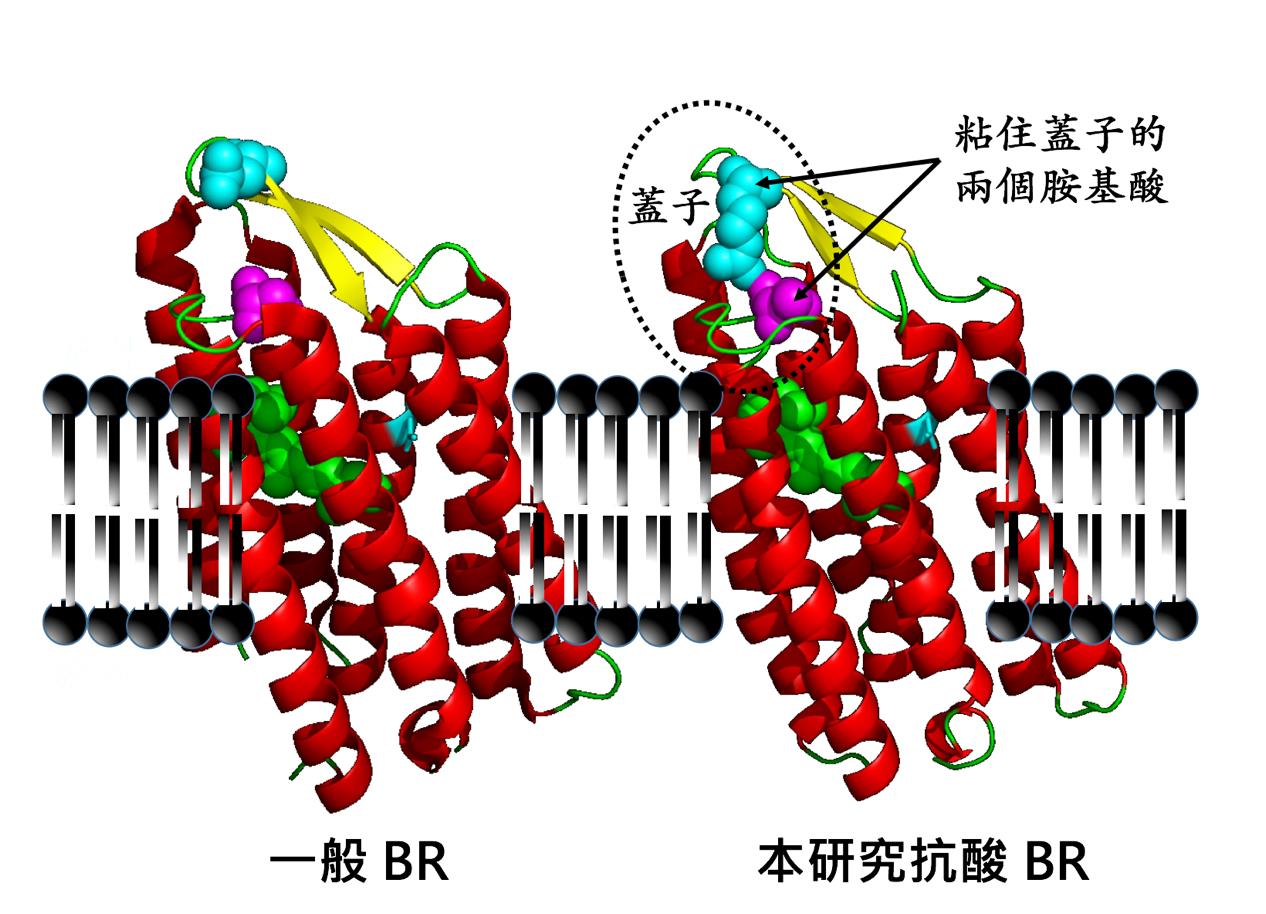
此一研究中,發現有一個獨特的此類的蛋白質(HwBR),其穩定性特別強,可以在別的同類蛋白質不再能產生能量的環境之下,繼續輕鬆產能。由結構中看到,原因是此蛋白質面對環境的那端,多出一個特別設計的「蓋子」,並且有兩個胺基酸,特別地將此蓋子「粘」牢,藉此將蛋白質內部和外在環境做出隔絕。
這個發現,不僅解釋了為何這個 HwBR 蛋白質,可以比起其它同類的 BR 蛋白質,不怕外在環境已有高質子濃度(即酸性環境),卻仍可以有效率地把質子打出胞外。也因為發現了這個蓋子,為科學界在此類 BR 蛋白質,分出一個新群組。這個發現,也對往後在蛋白質的設計工程有深刻的啟發意義。
事實上,任何一個獨特膜蛋白質結構被解出,都是科學上重大的突破。膜蛋白質之研究是高成本和高難度的。世界百年來,至2015年12月8日為止,已發表的十一萬四千個左右的結構檔案中 (www.rcsb.org),僅有 576 個不一樣的膜蛋白質。膜蛋白質結構之研究難度,可見一斑。
為何研究膜蛋白質結構此難呢?因為要解結構,需要大量蛋白質,但七穿膜蛋白質很難大量取得。臺大的楊伸老師實驗室和中研院王惠鈞副院長實驗室對七穿膜的大量表達(用菌體生產純化之意),有重大突破,因此才能解出其結構。並且,其中的一個大量表達系統向臺灣及美國申請專利,今年已獲得兩國專利局之批淮。
除此之外,為何解出七穿膜蛋白質這麼重要?這是一個可能已在地球存在三十億年的蛋白質。這類蛋白質,至今仍廣泛地為各式生物,以及人類身體所利用,舉凡視覺、聽覺、嗅覺、腦神經,以及甚多荷爾蒙的作用,都是這類七穿膜蛋白質來負責的。這可由目前市面上藥物,有一半以上都是針對七穿膜的 GPCR 看出。2012 年的諾貝爾化學獎的受奬人之一,就是 Brian K. Kobilka,以表揚他在 GPCR七穿膜蛋白質的研究貢獻。
據瞭解,臺灣目前尚有中研院馬徹博士解出一個單穿膜蛋白質結構;清大孫玉珠老師,則在2012年解出臺灣第一個多穿膜蛋白質。但七穿膜蛋白質,這是第一個。
這個結構,恰巧將於今年(2015)聖誕節當天,出版於著名的生物生理化學權威期刊,Journal of Biological Chemistry。供公眾存取的版本,已可下載:http://www.jbc.org/content/early/2015/10/19/jbc.M115.685065.long