分子醫學研究所李芳仁教授團隊論文成果發表《PNAS》
醫學院分子醫學研究所李芳仁教授的研究團隊日前發表創新論文,首度揭開誘發細胞中內質網(Endoplasmic reticulum,ER)壓力會進一步調控高基氏體(Golgi apparatus)的訊息傳遞及囊泡運輸。此新發現將提供研究內質網壓力引發相關疾病的硏究新方向。該論文於2016年3月10日刊登於自然科學領域重要國際期刊「美國國家科學院期刊」(Proceedings of the National Academy of Sciences ),並受到國際重視。
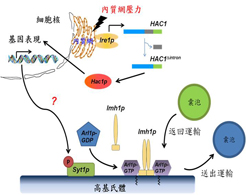
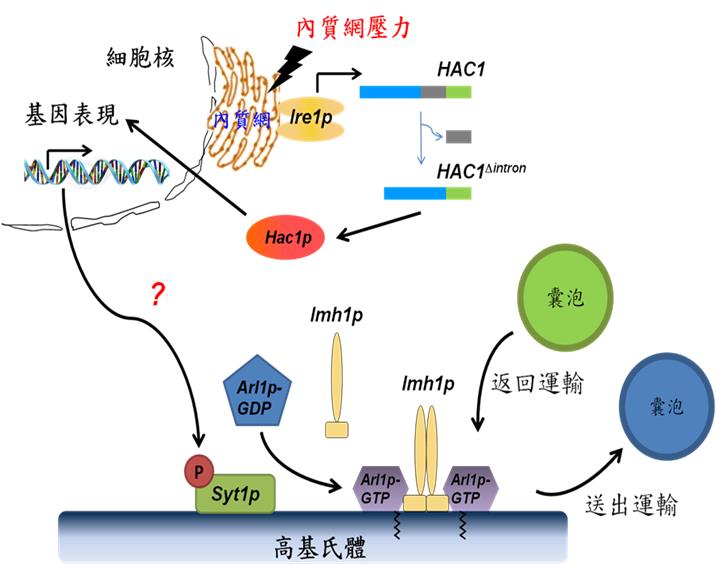
內質網是細胞內極重要的蛋白質與脂類的合成包裝運輸起點。在內質網內製造出的蛋白質先被摺疊(folding)、加工和修飾,再被運輸到高基氏體進行再修飾與分類包裝,最後以囊泡運輸到細胞膜上或分泌到細胞外,此機制的運作攸關生物的生命能否正常延續。細胞若受到外來環境的壓力或內在基因的變異,會導致蛋白質摺疊不正常,這些異常蛋白質若累積在內質網內,會形成內質網壓力(ER stress),並造成蛋白質摺疊不正常反應(unfolded protein response, UPR)上升。過去已有許多文獻報導指出很多疾病都和內質網壓力有關,例如:阿茲罕默症、帕金森氏症、糖尿病與癌症等。因此,剖析細胞對於蛋白質摺疊不正常反應的調控,對於了解細胞生理以及人類疾病具有重大的意義。
李教授實驗室長期以單細胞酵母菌(Saccharomyces cerevisiae)為模式生物,專注於研究細胞中囊泡運輸的調控機制。過去實驗室相關研究已證實小分子GTP水解酶Arl1p在細胞中囊泡運輸過程扮演重要角色,且其活化過程需要GTP交換因子Syt1p參與。然而,Syt1p在高基氏體活化Arl1p的過程及分子機制仍不清楚。本篇研究首度提出內質網壓力與高基氏體囊泡運輸存在重要聯結。當細胞累積過多未摺疊蛋白質時,壓力感受蛋白質Ire1p會被活化,使下游轉錄因子Hac1p順利合成並引發基因表現,此訊息傳遞會進一步使GTP交換因子Syt1p被磷酸化。磷酸化的Syt1p與Arl1p蛋白質的交互作用增強,而可活化Arl1p,並使其下游高基氏體結構蛋白質Imh1p亦被召回高基氏體上。本篇論文揭示了未摺疊蛋白質所誘發之內質網壓力可以透過訊息傳遞而影響高基氏體上的蛋白質分布,並進一步調控其囊泡運輸。了解高基氏體就未摺疊蛋白質累積品質的管控機制及其受內質網壓力的影響,將是實驗室未來的研究重點。
李教授表示,過去的研究大都著墨於如何調控及緩解各種細胞中內質網內未摺疊蛋白質的累積與相關疾病的研究,往往忽略了高基氏體管控的重要。本篇研究首開先河,指出細胞需要透過高基氏體囊泡運輸之協助來釋放內質網壓力,對於內質網壓力所引發相關疾病之分子機制提供嶄新的研究方向。
本研究工作最重要的執行者博士後研究員許家維博士,計畫由行政院科技部支持。參考網站: Unfolded protein response regulates yeast small GTPase Arl1p activation at late Golgi via phosphorylation of Arf GEF Syt1p (http://www.pnas.org/content/early/2016/03/09/1518260113).