臺大學術卓越系列報導—生命科學院突破性研究成果
本校生命科學院涵蓋研究領域多元且各具特色,學院的研究發展強調應用分子、細胞、生化、生物技術、功能性基因體、蛋白質體、基因工程及生物資訊學等技術與方法,探討動物、植物、微生物等之形態、生理、代謝、遺傳、環境適應等基礎生命科學領域,並跨及生技產業應用領域。近年來生命科學院持續展現突破性研究成果,發表至國際頂尖期刊,謹列舉幾項代表性成果,與臺大師生同仁分享。
揭開視覺網路發育的分子機制-分細所王致恬老師
我們能夠看到這繽紛美麗的世界完全倚靠視覺,視覺成像始於眼睛內的視網膜細胞;眼睛是靈魂之窗,透過眼睛我們才能在看到照片時勾起許多美好的回憶;所以一旦失去視覺,人生便會失去許多的光彩;但如此精密的視覺網路是如何形成的?已知視覺系統在發育時期,有一種「視網膜波」,以一分鐘一次的速率橫掃數百個視網膜細胞,並傳播至整個大腦視丘及視覺皮質。因為一起有同步視網膜波的神經元會連接至同一處,使左右雙眼的視神經得以投射到大腦視丘的不同區域,形成精準的視覺網路。然而,迄今未明的是,視網膜細胞中是否存在某種特定的分子,可以調控視網膜波及視覺網路的形成?分子細胞所王致恬老師研究團隊與長庚大學盧主欽老師團隊之合作,發現一種新的調控視覺網路發育的分子機制,此項研究已發表在美國國家科學院院刊(PNAS; 參考網站:https://www.pnas.org/content/116/8/3262.long );主要敘述在發育中視網膜特定的神經元內,存在一種調控神經傳導的分子(SNAP-25b),其上特定的胺基酸(T138)被蛋白激酶A磷酸化後,可抑制神經傳導的強度和視網膜波的時空性質,而這些變化足以進一步引起全面的效應,改變視網膜連結至大腦中樞的視覺網路。
氣候暖化讓生物縮小了-生演所何傳愷老師
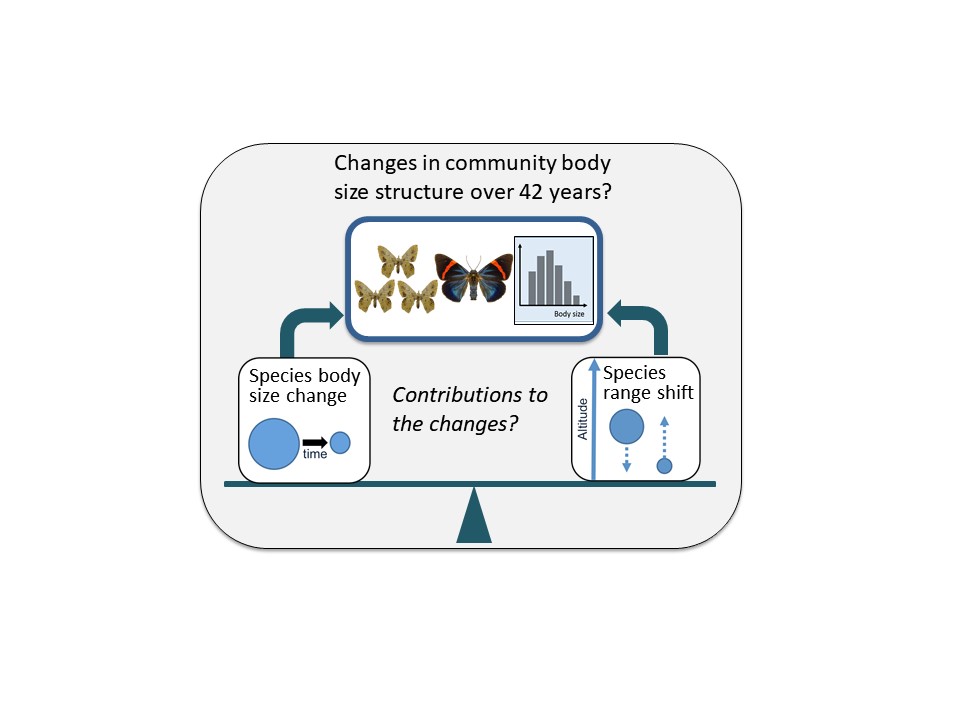
從古至今,人們對縮小世界的想像不曾停止,如西遊記的孫悟空能把身體縮小,漫畫小叮噹(哆啦A夢)擁有縮小燈,電影“親愛的,我把孩子縮小了”、“驚異大奇航”、“蟻人”等皆有將人物縮小的精彩情節,然而,氣候暖化讓這一切不再只是想像!由生態學與演化生物學研究所何傳愷老師所指導的吳忠慧同學,其碩士論文探討氣候暖化如何影響生物的體型大小,分析馬來西亞神山(與玉山高度相近)跨海拔的尺蛾族群,發現過去42年0.7°C的暖化讓這些生物體型縮小了約5%。此研究提供氣候暖化影響生物的重要證據,已於2019年10月10日國慶日發表在國際期刊Nature Communications。
生物體型大小會影響生物的生理機制、個體互動、生態系統穩定,因此一直是生態學重要的議題,不過,當今的氣候暖化會如何影響生物群聚的體型呢?吳忠慧同學與何傳愷老師推測有兩個主要機制:一、根據經典的Bergmann’s rule來推論,暖化會讓生物個體變小。二、根據現今的研究來推論,暖化會讓物種往高海拔、高緯度播遷,進而改變原有的群聚組成與體型結構。然而此研究需要長期系統性採集的標本,在多數博物館經費拮据下,這些標本在世上非常稀有。所幸在成大陳一菁老師與英國團隊的大力協助下,此研究逐漸成形。研究初期缺乏經費,因此吳同學與何老師自籌經費,支付吳同學至英國自然史博物館找尋並測量數千隻尺蛾標本的開銷,在不知成果的情況下,頗有重拾臺灣人“提著一個皮箱闖全世界”的勇氣。
解決了標本的難題後,遇到另一個難題: 野外採集的標本同時反映了暖化下的兩個機制(個體變化與物種播遷),要如何量化各自對群聚體型變化的貢獻度呢? 吳同學發揮創意,利用模擬讓過去42年(1965-2007)的暖化重新發生,但一次只讓一個機制運作,藉此量化各機制的影響。此研究自2012年起構思,數年努力的結果顯示神山42年0.7°C的暖化讓尺蛾群聚的平均體型縮小了約5%,而物種播遷與個體變化各自占了約八成與一成多的貢獻度,凸顯暖化下物種播遷的影響性。此外,平均體型縮小的現象在高海拔尤其明顯,其主要機制為個體較小物種往高海拔播遷,而高海拔物種數低的特色會放大任何生態上的改變。
此研究結合臺灣團隊的構思與英國團隊的支援,率先提出氣候暖化讓野外生物縮小的證據、量化其機制,並詮釋經典的生態學研究(如標本採集)在現代“人類世”面對各種環境挑戰下的重要價值。
人類幹細胞研究成果—生科系蔡素宜老師
生命科學系蔡素宜老師主要是利用人類多能幹細胞為模型,其研究主要可以分為二大主軸:一、研究如何改善心臟各個細胞譜系(cardiac lineages)細胞分化的效率, 並藉由細胞分化的過程來探討心臟細胞譜系的發育機制。二、利用人類多能幹細胞作為心臟疾病的模型並探討心臟疾病病理機制及利用高通量藥物篩選找出治療心臟疾病之有效藥物。心臟細胞譜系包含心肌細胞(心房及心室)及心臟傳導細胞(竇房結,房室結及浦金氏纖維)。其中雖然心肌細胞已有很好的分化方法,但如何有效率的純化這群細胞,卻仍是目前此研究領域所面臨到的問題。另外目前的藥物開發所耗費的時間跟經費都是非常可觀的,但至少有90%以上的藥物開發最後仍是失敗的,最主要的原因是因為藥物治療所引起的心臟毒性及腎臟毒性,因此建立測試心臟毒性的平台是非常急迫的。蔡老師團隊利用CRISPR/Cas9的技術建立了人類心臟報導幹細胞株,並利用此心臟報導幹細胞株建立了測試心臟毒性的平台。蔡老師團隊並藉此平台發現單一不飽和脂肪酸會誘導心律不整,而其病理機制是透過調控RYR2,KCNJ2 和KCNA4基因的表現。此研究成果發表在Cardiovascular Research期刊中,是由碩班生王厚潤及博班生許子庭協助完成。
蔡老師研究團隊近期的另一篇研究成果,發表在Nature Communications。該研究是與中研院夏國強助研究員的跨領域合作成果,夏老師研究團隊主要是利用蛋白質結構生物學去探討細胞核運送因子(Importin-))如何與高基氏體蛋白基因GM130作用, 進一步調節細胞分裂的過程。利用該團隊在結構生物學中發現的結合位點,蔡老師研究團隊利用他們非常擅長的CRISPR/Cas9技術在GM130上做不同位點的點突變細胞株。由於其中GM130-K34A這個突變位點是很重要位點,因此挑了500多單細胞株,才拿到3個異質株(heterogeneous)。利用這些突變細胞株與一連串的生化研究,發現了一種分子機制,允許細胞核運送因子抑制高爾基體 (Golgi) 與囊泡 (vesicle) 融合,進而允許在有絲分裂時高爾基體分解。因此本研究結果證明細胞核運送因子除了能夠媒介細胞核與細胞質間物質的運輸外,細胞核運送因子在細胞分裂時還能夠調控錘體組裝和高爾基體分解。在蔡老師研究團隊中,此項研究是由當時僅是大學部學生陳靜柔及卞毓中協助完成。
培養人類幹細胞不僅花費昂貴且沒有所謂放假可言,永遠都是風雨無阻。但因為人類幹細胞在再生治療,疾病模型及藥物篩選上都有無限的潛力,因此蔡老師的研究團隊仍努力的堅持,希望有一天團隊的研究能對人類疾病的治療有所貢獻。
參考網站:
https://academic.oup.com/cardiovascres/advance-article/doi/10.1093/cvr/cvz148/5512499
https://www.nature.com/articles/s41467-019-12207-4
https://suyitsai.wixsite.com/website
臺大與中研院團隊發現「治療神經母細胞瘤」的新曙光-生科系李心予老師神經母細胞瘤是一種目前最常見的「小兒顱外固態惡性腫瘤」,好發於嬰幼兒時期,臺灣目前每年約有30個病例確診,嚴重威脅病童生命。臺大與中研院研究團隊經過15年努力,發現了一個新穎且相對安全的治療方式,研究成果已發表於國際頂尖期刊,並提出多國專利申請。預期近年內能完成新藥研發,為病患帶來新希望。
研究團隊指出,神經母細胞瘤是目前最常見的小兒顱外固態惡性腫瘤,85%的病例發生於4歲以前,臺灣目前每年約有30個病例確診,由於其好發於腎上腺,致使早期的發現不易,約有一半以上的病童在診斷時便已發生了多處轉移或擴散,但目前治療成效往往不彰,嚴重威脅病童生命。
本校和中研究的跨領域研究團隊,經過長達15年持續努力,達成了兩項獨步全球的重要研究成果,一是發現「芳香烴接受器 」(Aryl hydrocarbon receptor) 有助於病患之治療,二是透過團隊自行研發之篩選平臺,鑑定出芳香烴接受器之內源性配體「四氫皮質酮」(內源性配體亦即人體本身所產生的內源性賀爾蒙),可誘導神經母細胞瘤分化以減緩腫瘤生長的可能性,明顯減緩神經母細胞瘤的生長及擴散; 而且與坊間「毒性」藥物殺死癌細胞方式不同,是對病人身體相對安全的治療方式。此兩項成果均已發表於國際頂尖期刊包括《癌症研究》(Cancer Research)以及《美國化學學會化學神經科學》(ACS Chemical Neuroscience) 期刊。