遺傳性巴金森症新穎致病基因與粒線體相關機制研究 榮登頂尖期刊Brain
臺大醫院神經部林靜嫻教授與吳瑞美教授團隊,發現導致遺傳性巴金森症新穎致病基因與粒線體相關機制,此論文榮登頂尖期刊《腦》(Brain)。
巴金森氏症為相當常見的神經退化性疾病。有鑑於世界人口快速老化,世界衛生組織預估,目前罹患此神經退化性疾病的全球人數,將由2005年的4百萬人增加至於2030年的9百萬人。臨床症狀上,巴金森氏症病患出現顫抖、動作遲緩、肢體僵硬以及重心不穩等症狀;最重要的病理特徵為多巴胺神經細胞退化,多巴胺不足導致動作功能遲緩。目前並無根治方法,雖有補充多巴胺的藥物治療或是深腦電刺激手術,病情仍會隨病患年齡增加而惡化。因此,釐清疾病致病機轉,找出以機轉為導向的治療為目前首要課題。
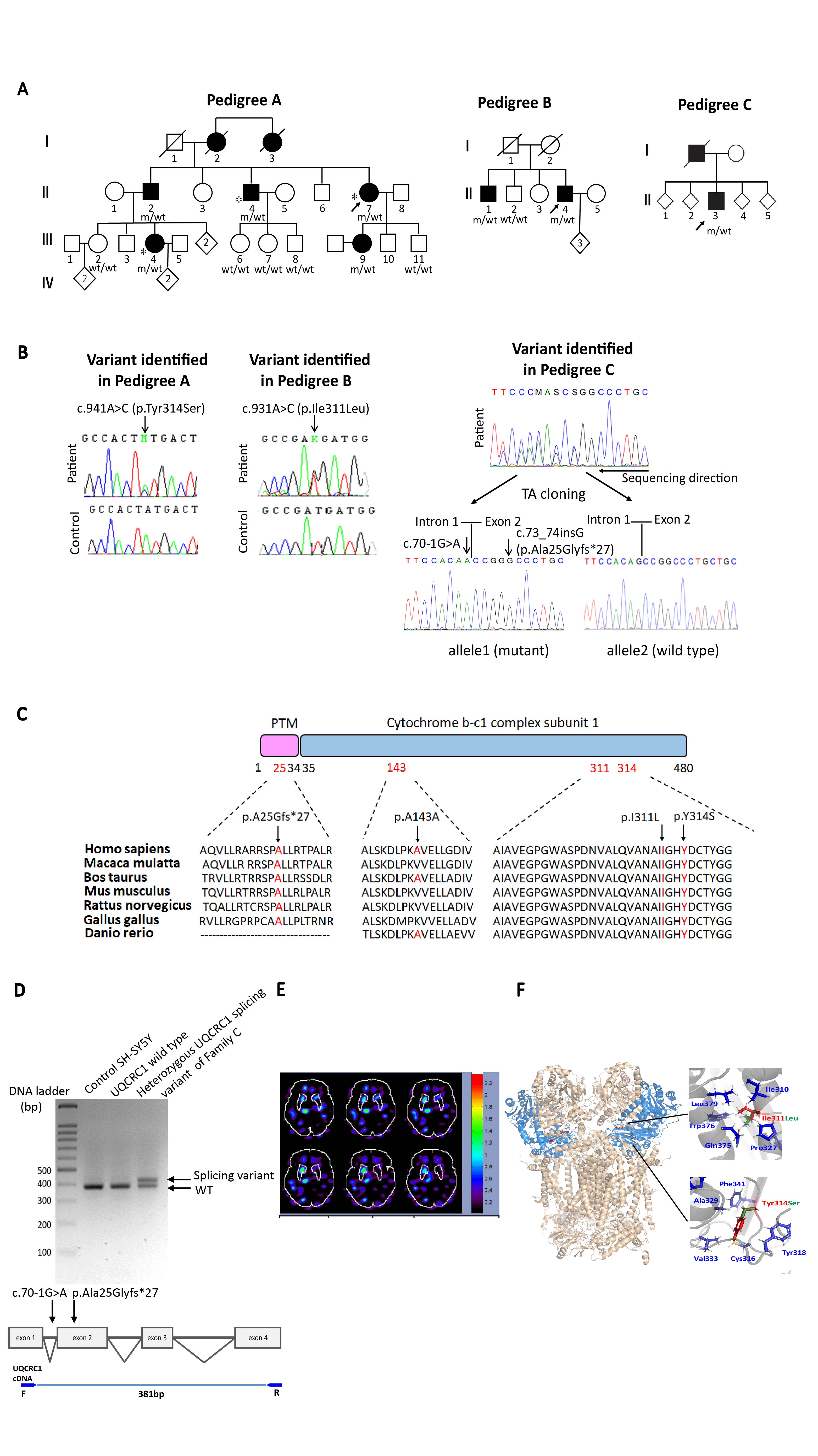
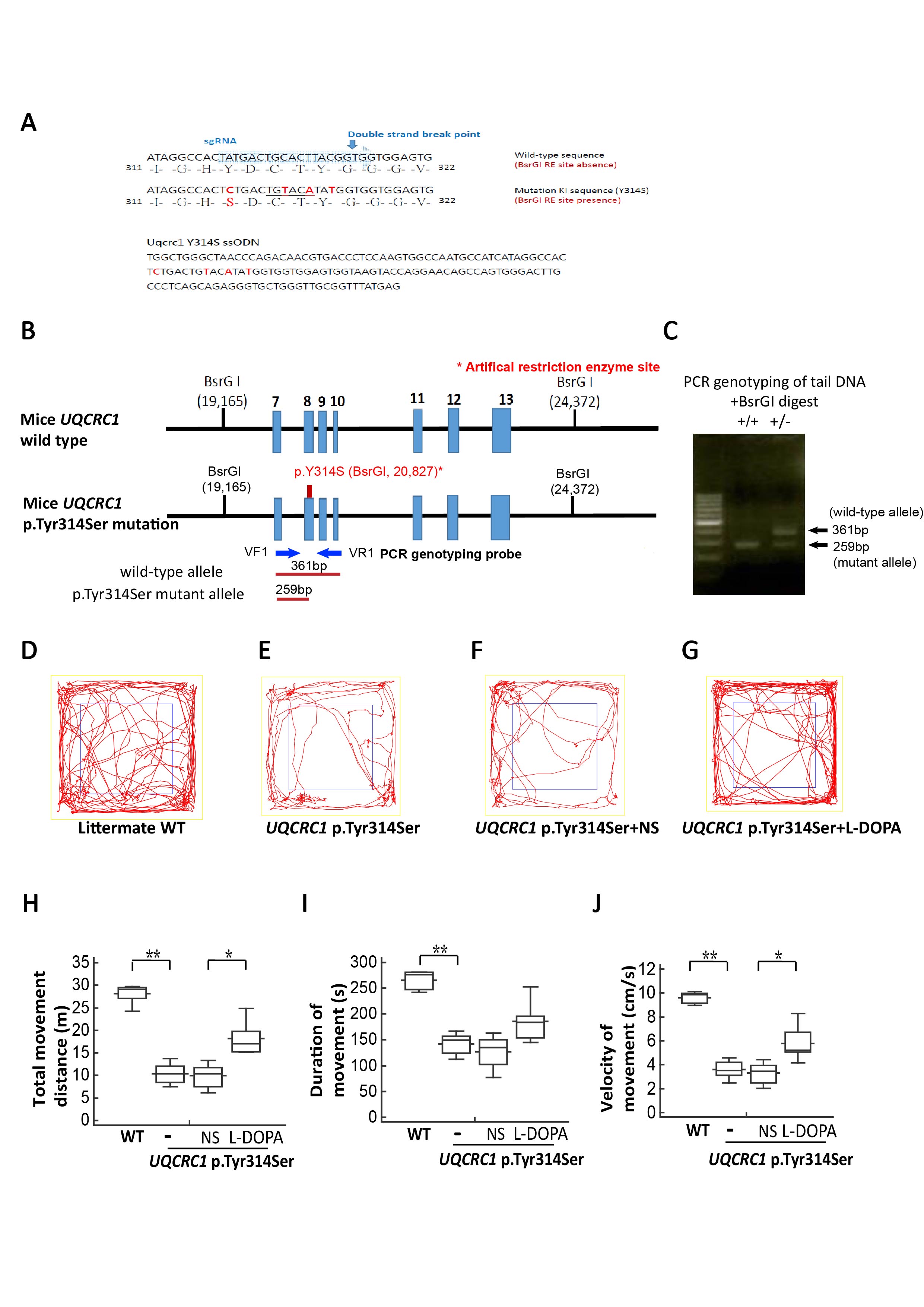
巴金森氏症的致病機轉為易感基因的變異,與環境危險因子及老化的交互作用,因而導致多巴胺神經細胞凋亡。臨床上有將近10%的病患為家族性或是年輕型患者,這些家族目前已有超過30個基因被發現導致遺傳性巴金森氏症,探討這些基因拼圖下游的蛋白質功能於神經細胞中扮演的角色將有助於釐清巴金森症致病機轉。研究團隊過去已成功釐清臺灣年輕型與家族型巴金森症家族協助的致病基因突變藍圖,為亞洲第一個完整探究年輕型與家族性巴金森症的基因與臨床表現型世代追蹤研究(Lin CH et al., Mov Disorders, 2019 Apr;34(4): 506-515.)。本篇論文,為團隊更進一步以全外顯子定序分析,探索不帶有上述已知基因突變的顯性遺傳巴金森症家族,並結合與日本與韓國共近500個巴金森症家族,找出一新穎導致遺傳性巴金森症家族的致病基因UQCRC1 (Ubiquinol-Cytochrome C Reductase Core Protein 1)。此為粒線體電子傳遞鍊上第三複合體的核心蛋白,團隊以CRISPR/Caspase 9技術建立帶有該突變的基因嵌入細胞、果蠅與小鼠模式,進行致病機轉探討,證明此位於粒線體電子傳遞鍊第三複合物蛋白的突變,導致粒線體功能缺損、細胞中自由基增加;隨年齡增長,其神經功能退化與動作障礙加劇(Lin CH et al., Brain, 2020 Dec 5;143(11):3352-3373),本團隊研究結果除了更加證明粒線體功能對巴金森症致病機轉的樞鈕角色外,更進一步發現粒線體電子傳遞鍊上第三複合體功能對多巴胺神經細胞存活與巴金森症致病機轉的重要性。
團隊將致力於開發優化神經細胞中粒線體功能的治療策略,希望能於巴金森氏症疾病初期或甚至是前驅症狀時期,減緩多巴胺神經系統退化,為巴金森氏症患者的機轉導向治療帶來曙光,以減少老化社會的負擔。
參與本研究的實驗室研究人員還包括林翰宜、鄭捷、陳孟伶博士與柯怡綺,合作夥伴詹智強老師、曾秀如老師、謝松蒼老師、李妮鍾醫師、顏若芳醫師、趙啟超醫師、蔡欣熹醫師、賴星融醫師、洪瑜謙博士、羅文君同學與醫學院第一共研黃呈彥博士、林淑華老師與游益興博士。
詳細研究成果請參閱正式發表的全文:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7719032/pdf/awaa279.pdf