既分工又合作—在細胞遷移時扳倒大鯨魚的小蝦米們
本校醫學院藥理所蔡丰喬老師與團隊成員們(以下簡稱團隊),研究人類細胞在遷移時,內部的軟體(訊息傳遞)與硬體(細胞骨架),如何互相影響,分進合擊。此研究成果於2021年7月刊登於美國科學促進會(AAAS)的知名期刊《科學進展》(Science Advances),預期將對生命科學的發展與臨床治療學的推動有重大影響。
團隊所研究的細胞遷移,是胚胎發育、組織再生與免疫活化時不可或缺的助力;而不正常的細胞遷移,更會造成免疫失調與癌症失控的可怕後果。因此細胞如何遷移,一直是生命醫學研究者的重點項目。近年來的努力使科學家們逐漸明瞭細胞這台「汽車」在「行駛」時所使用的各種組件,包括以黏著斑為輪胎,粗細肌絲為動力與方向盤,生長因子受器為照後鏡與倒車雷達等。然而,關於細胞如何操縱這些組件,成為高明的駕駛員,卻一直是未解的難題;也因此我們遲遲無法把細胞遷移,應用在臨床治療上。
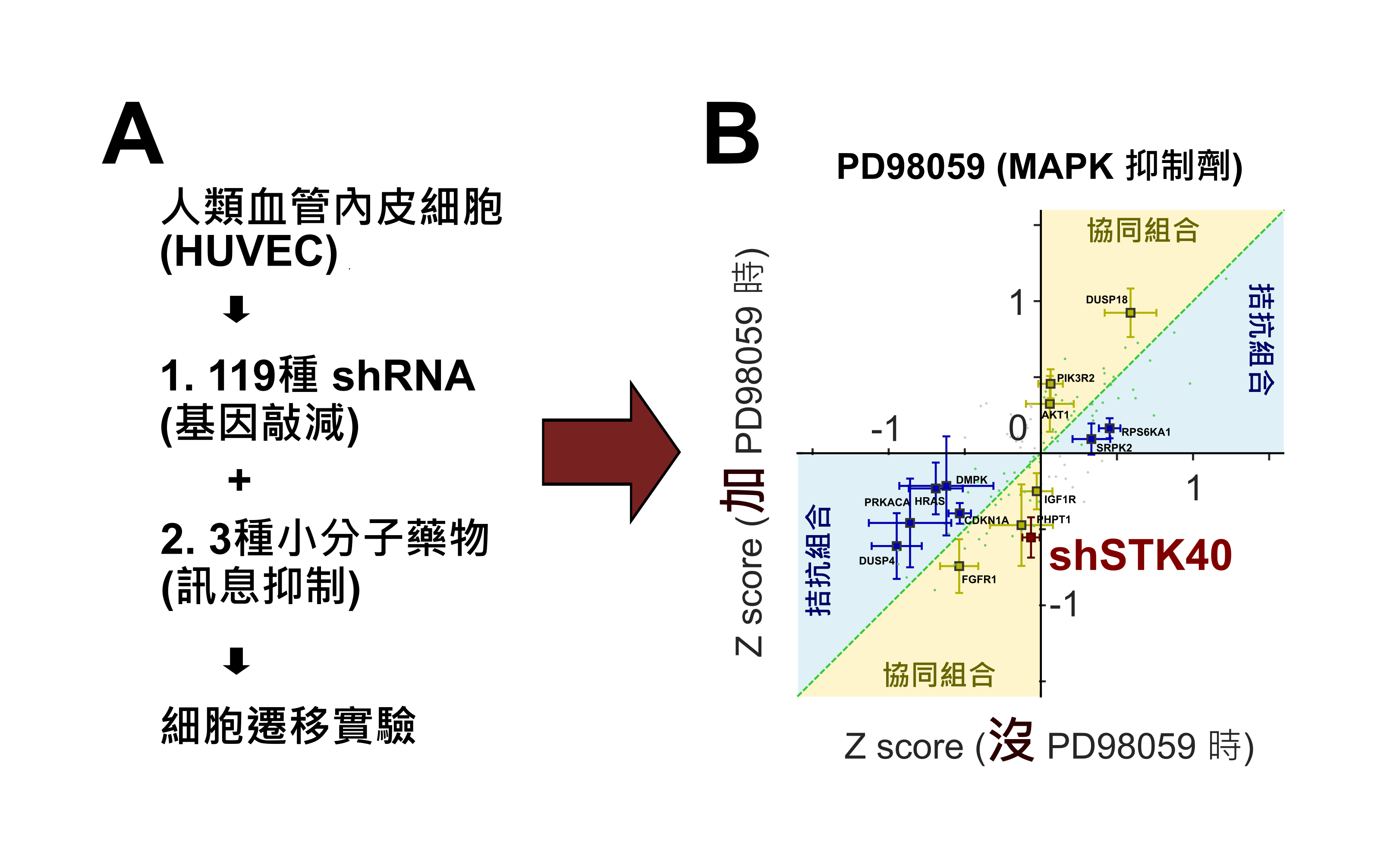
為克服這個障礙,團隊採用系統生物學的「精準打擊」與「高通量篩選」策略,合併藥物抑制與基因敲減技術,雙管齊下,找出組件間如何互相合作,有效遷移細胞(圖一A)。在中研院基因體中心的協助下,他們的篩選實驗找到了多種重要的分子組合,對細胞遷移有協同或拮抗效果(圖一B):每個組合內的分子個別看來,像不起眼的小蝦米,對細胞遷移的影響不大;但當它們合在一起,卻能發揮 1+1>2 的威力﹐扳倒大鯨魚,改變細胞遷移。因此,這些小蝦米們的合作模式若能被清楚確認,就可使它們如「麟洋配」般默契配合,發揮奧運奪金的威力。團隊目前對其中一個分子協同組合「STK40-MAPK」的機轉,已有相當瞭解(圖二):這兩個分子作用模式不同,卻能合力調整YAP 這個細胞分化的主控手,重組細胞骨骼,最終改變細胞的貼附強度與遷移能力;團隊目前正對上述機轉的細節進行確認,並發展其於控制血管新生與治療癌症轉移的應用。其他分子組合的研究,也正緊鑼密鼓進行中。
這種分子組合的協同或拮抗模式,團隊命名為「合成阻動」(synthetic dysmobility)。名稱上雖然與近年來熱門的「合成致死」(synthetic lethality)類似,合成阻動卻有兩個重大的觀念突破:首先,相對於合成致死強調「與病魔決一死戰」的零和關係,合成阻動著重正常生理狀態的回歸,與疾病和平共存,這樣的想法巧妙地與中醫治療學的「正邪相安」對應。更有趣的是:相較於合成致死在合作關係中強調的「分進」,合成阻動更著重「合擊」帶來的綜效作用,這種想法也與中醫治療學的「君臣佐使」相符。這兩個巧合顯示:合成阻動觀念可打通「將傳統醫學科學化」的康莊大道,相信能在不遠的將來,為臨床治療帶來重大突破。
蔡老師與團隊將持續努力,為科學與醫療帶來更美好的未來!
研究成果全文:Synthetic dysmobility screen unveils an integrated STK40-YAP-MAPK system driving cell migration
於2021年7月28日發表於《科學進展》(Science Advances):https://doi.org/10.1126/sciadv.abg2106