內質網壓力誘導高基氏體逆向運輸功能之新發現
本校醫學院分子醫學研究所李芳仁教授團隊長期研究內質網壓力(Endoplasmic reticulum stress, ER stress)反應的功能,日前首度揭示內質網壓力具有誘發高基氏體(Golgi)逆向運輸(Retrograde transport)的功能,此一功能由促分裂原活化蛋白激酶(Mitogen-Activated Protein Kinase, MAPK)所調節。此項研究成果發表於細胞生物學權威期刊《細胞報導》Cell Reports,受到國際高度重視。
內質網與高基氏體是支持正常細胞生理不可或缺的胞器,細胞的蛋白質胜肽(peptide)合成後,需要經過內質網的折疊與修飾,再送到高基氏體進行再修飾以及運送,以執行其蛋白質功能。然而,錯誤摺疊的蛋白(misfolded proteins)若無法被細胞消除或運送,則會累積於內質網中並且引發內質網壓力,可能造成內質網功能失衡,甚至導致細胞凋亡。科學界已有許多文獻指出內質網功能失衡將引發諸多疾病,包含免疫功能失調、第二型糖尿病、癌症以及神經退化疾病,如:阿茲海默症、帕金森氏症和亨丁頓舞蹈症。因此,研究細胞的內質網壓力反應功能(ER stress response)有助於了解最基礎的細胞生理,並提供臨床疾病的治療方針。
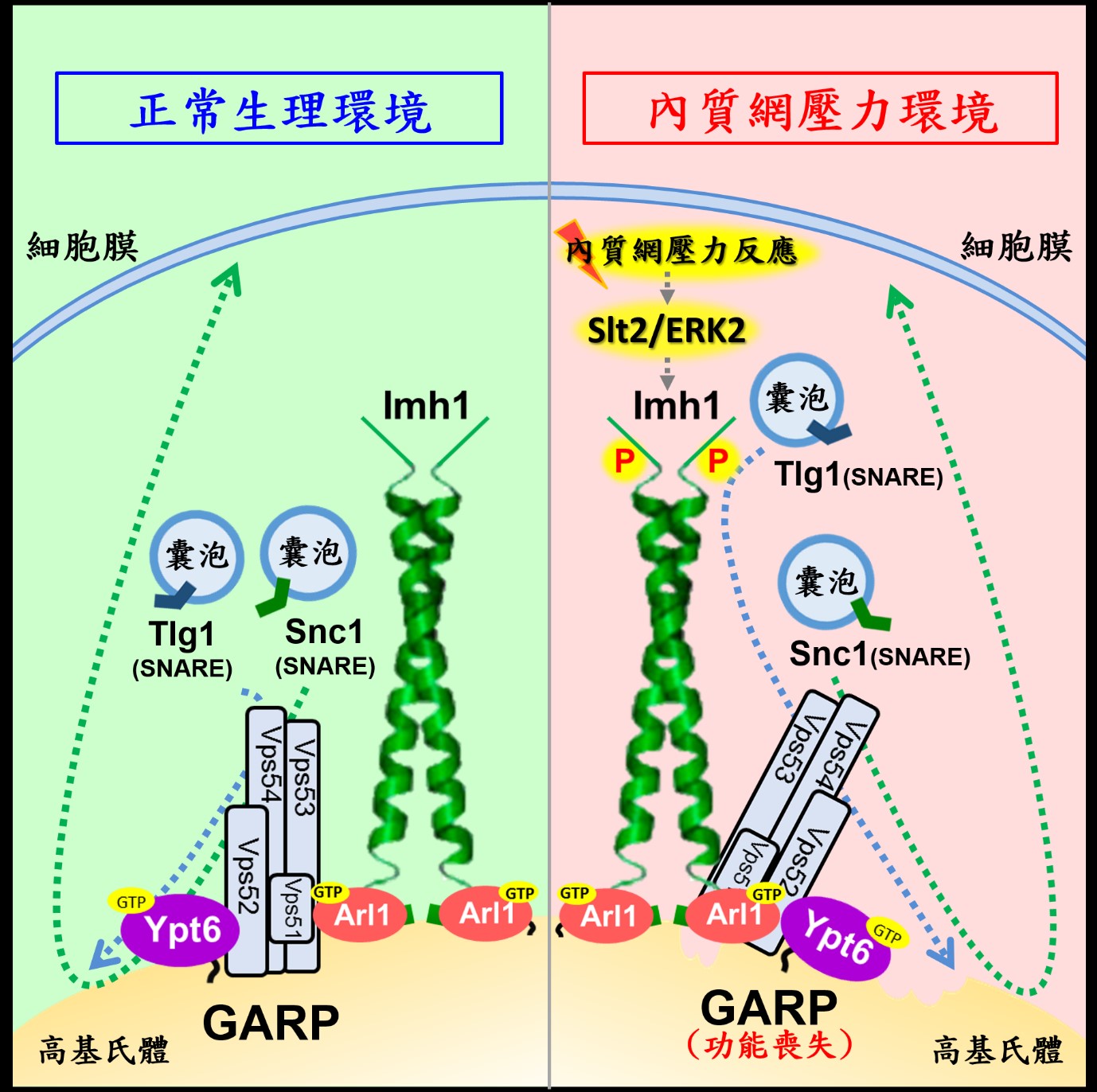
內質網壓力反應在真核生物(Eukaryotes)中具有高度保留性,李教授團隊以釀酒酵母(Saccharomyces cerevisiae)為模式生物進行研究。李教授團隊在先前的研究中已發現內質網壓力會誘使高基氏體上的小分子GTP水解酶Arl1活化,同時大量召回下游高基氏體結構蛋白質Imh1至高基氏體。然而,大量活化的Arl1以及Imh1在內質網壓力中所扮演的角色尚不清楚。本篇研究首度發現內質網壓力破壞高基氏體的逆向運輸功能,故需大量召回Imh1以彌補此功能。在正常生理的細胞中,許多蛋白質的運輸是以囊泡(vesicles)包覆的方式運送。而逆向運輸的蛋白質囊泡需要透過高基氏體上的連繫蛋白複合體(tethering complex)GARP complex(Golgi-associated retrograde protein complex)與SNARE蛋白質合作將蛋白質囊泡運送至高基氏體上。李教授團隊發現,內質網壓力會促使GARP complex失去功能,導致SNARE蛋白質所挾帶的蛋白質囊泡無法被高基氏體接收。此時,細胞便將大量的Imh1召回高基氏體上,以彌補GARP complex所失去的功能,幫助SNARE蛋白質所挾帶的蛋白質囊泡運送至高基氏體。此外,內質網壓力亦會促發Imh1磷酸化修飾(phosphorylation),經磷酸化修飾後Imh1才有支持逆向運輸的功能。過去文獻普遍認為內質網壓力反應主要受內質網上的磷酸化激酶Ire1的活化而啟動,但是本篇研究發現Imh1的磷酸化修飾不受Ire1調控,而是受到促分裂原活化蛋白激酶Slt2/ERK2所控制。
此研究首度發現高基氏體在內質網壓力中的重要功能,並且揭示內質網與高基氏體訊息傳遞的交互作用與合作關係。此結果開啟內質網壓力反應功能的新視野,有助於了解細胞遭受壓力時,如何維持細胞內的運輸恆定以及蛋白質品質的管控。李教授團隊未來將繼續致力研究高基氏體的逆向運輸如何幫助細胞解除內質網壓力,期能對治療臨床疾病提供重要方向。
本研究工作經費由行政院科技部及教育部支持。研究成果已於2022年3月28日刊登於Cell Reports期刊:https://doi.org/10.1016/j.celrep.2022.110488