臺大特色研究系列報導—生命科學院突破性研究成果
何銘洋老師—新種藍綠菌揭開光合作用演化之神秘面紗
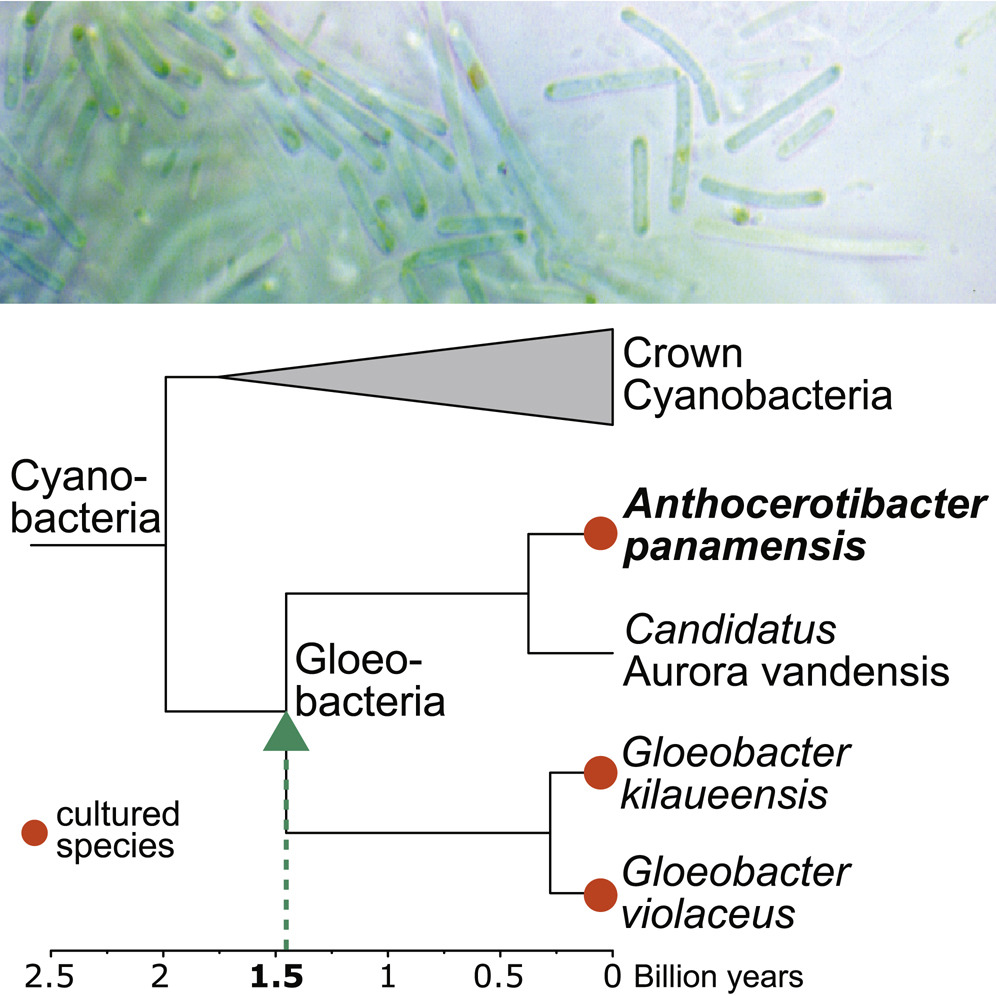
藍綠菌是一群地球上最早行光合作用產生氧氣的細菌。它們大約在35至25億年間嶄露頭角,開始製造氧氣並改變地球大氣成分,間接造就後續繁複的生命演化。
本院生命科學系助理教授何銘洋和美國康乃爾大學Boyce Thompson Institute助理教授李飛葦跨國團隊合作,發現一株演化早期分支的新種藍綠菌,提供光合作用演化幾十億年間空白新的線索。該研究於2021年5月刊登於國際知名期刊Current Biology。很巧的是,何老師和李老師皆為本院生命科學系同屆系友,在畢業多年於臺灣和美國分別就任教職後,因緣際會,在彼此專業互補下合作完成這篇研究。
何老師表示,研究藍綠菌是因為它們是了解光合作用演化和多樣性的關鍵。「我們沒有辦法回到過去觀察當時的光合作用,但是可以從保留原始性狀的物種當中去推導演化過程。」
在20億年左右,藍綠菌分支為兩群,一群為有葉綠囊膜的冠群藍綠菌(Crown cyanobacteria),大多數藍綠菌皆屬於此類;另一群為保留原始性狀,沒有葉綠囊膜的膠藻菌(Gloeobacteria),過去只有兩種被分離培養的菌株。因為缺乏演化早期代表性的物種,增加研究光合作用演化的困難。
在這篇研究中,研究團隊從巴拿馬熱帶雨林的角蘚成功分離並培養出一株獨特的藍綠菌,並命名為Anthocerotibacter panamensis。這個新種屬於膠藻菌,但在14億年前和其他膠藻菌分支。它和其他膠藻菌一樣缺少葉綠囊膜和生理時鐘的基因,但不同的是,它的胡蘿蔔素合成途徑和冠群藍綠菌相似。和冠群藍綠菌不同的是,它缺少光合作用的一些基因,卻依然能行光合作用產生氧氣。由於這個物種的發現,填補了20億年到14億年藍綠菌的空白,讓我們未來有機會可以更加瞭解光合作用的演進過程。
何老師表示:「此篇文章是在實驗室草創時期發表,大多是我親自做實驗收數據,後來助理陳珮瑜加入,幫忙顯微鏡分析。有些儀器一開始還沒建立好,得去中研院朱修安老師實驗室借用,因此這段期間很感謝朱老師的幫忙。」何老師也感謝臺大、科技部愛因斯坦計畫,以及教育部玉山青年學者計畫支持完成研究。
文章連結:A novel thylakoid-less isolate fills a billion-year gap in the evolution of Cyanobacteria
圖片來源:Current Biology
林盈仲老師—以C++語言開發軟體分析木材基因調控
真核生物透過轉錄因子與其下游DNA的物理性結合而開啟基因表現,酵母菌單雜交是目前科學界最廣泛使用於鑑定轉錄因子與下游DNA物理性結合的技術,在近十年來,酵母菌單雜交甚至被開發成高通量平台進行數以萬計的篩選,然而這些平台在執行速度與發現效率上各有缺點。
本院生命科學系副教授林盈仲研究團隊與多個國際團隊合作開發出一個同時具有最快速度以及最高發現效率的平台,稱為減數分裂酵母菌單雜交法(PMID 31186303, Genome Research, 2019)。國際團隊成員包含中研院基因體中心張典顯研究員、美國北卡州立大學Vincent L. Chiang教授、美國北卡州立大學Jack P. Wang教授、中國東北林業大學李偉教授。
由於篩選速度和效率的提升,減數分裂酵母菌單雜交平台進而產生大量數據,數據量已經無法由人工分析能夠完成,甚至生命科學界時常使用的程式語言R或Python的運算速度也不足以滿足,於是該團隊與陽明交通大學蘇溶真教授以及中研院基因體中心張典顯研究員合作,以C++程式語言開發出一套運算速度快的軟體,稱為GateMultiplex,可用於快速分析木材形成過程基因的上游調控轉錄因子(PMID 34560855, BMC Biology, 2021)。同時也展示GateMultiplex的分析能力可以應用在其他生命科學領域,其中包含癌症藥物開發、智慧農業品種選育(與臺中農試所合作)、遠洋漁業污染鑑定(與臺大漁業科學所柯佳吟教授合作)等。未來則期望使用減數分裂酵母菌單雜交平台搭配GateMultiplex分析軟體,揭示木材形成過程中的大型轉錄調控網路。
文章連結:Large-scale data analysis for robotic yeast one-hybrid platforms and multi-disciplinary studies using GateMultiplex
圖片來源:BMC Biology
蔡素宜老師—心臟剪接因子對肌節形成的分子機制
本院生命科學系副教授蔡素宜研究團隊主要利用人類潛能幹細胞為模型來研究人類心臟發育與心臟病病理機制的探討。
心肌病變(Cardiomyopathy)是一種常見的心臟疾病,患者因爲心臟肌肉的病變,導致心臟無法執行正常功能,由於目前對心肌病變的治療藥物都僅是支持療法並沒有辦法根治,病人到最後往往需要等待換心否則可能導致死亡。因此,如何找到有效的治療方法是目前非常急迫需要解決的議題。
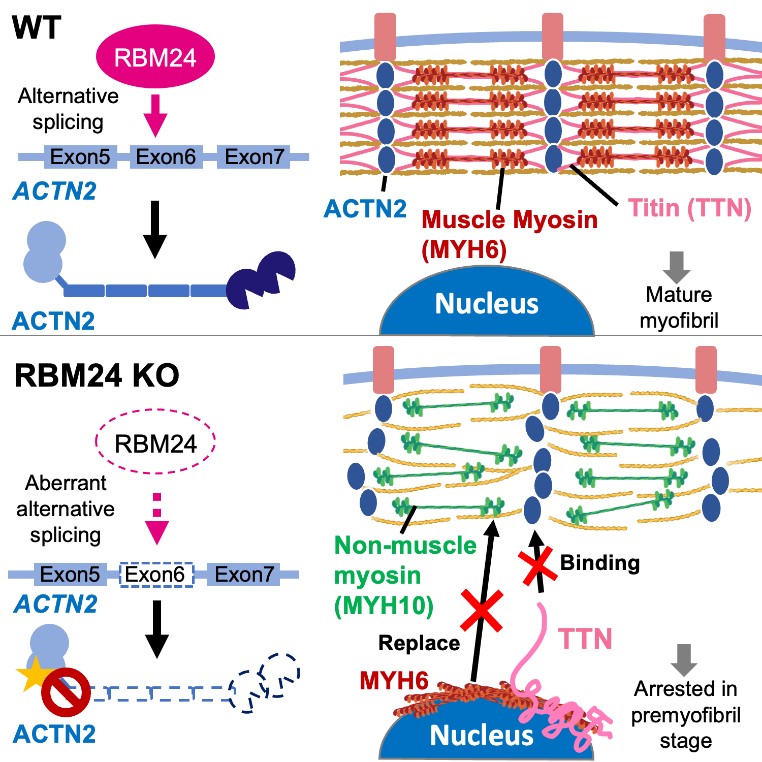
肌節(Sarcomere)是心肌的基本單位,其由上百個肌節蛋白所組成,臨床研究發現許多肌節蛋白的基因變異,都可能導致心肌病變的發生。因此,若能了解形成正常肌節背後的上游分子機制,將有助於找出更多心肌病變的成因及潛在治療方式。
RBM24(RNA-binding motif protein 24)是目前已知的一個心臟剪接因子,可透過選擇性剪接影響肌節的結構,然而其在心肌發育上的功能及分子機制並不清楚。因此,蔡老師實驗室利用人類潛能幹細胞株,來探討RBM24 在心肌發育的角色。研究團隊發現 RBM24 在心肌分化過程中,於不同時期階段性調控眾多肌節相關蛋白,可以視為一個心肌發育的主調控者(Master regulator)。有趣的是,他們發現 Z 線錨定蛋白 ACTN2 的肌動蛋白結合域(ABD;由外顯子 6 編碼)主要在心臟早期分化時被排除(Exon exclusion)在外,而它最終會被包含(Exon inclusion)在成人心臟中。最後他們證明 RBM24在心臟分化早期的肌節形成中參與重要的功能,其缺失將使 ACTN2 的外顯子 6(Exon6)被排除(Exon exclusion)。他們同時發現RBM24 所調控的肌節蛋白當其變異時都與心肌病變密切相關,因此,蔡老師團隊證實 RBM24 在心肌發育過程中扮演著重要的調控角色,並且擔任許多心肌病變基因的上游調控者,因此這份研究可望替未來心肌病變提供新的治療策略。此研究成果發表在國際知名心臟領域重要期刊 Circulation Research。
培養人類潛能幹細胞不僅花費昂貴且沒有所謂假日可言,但人類潛能幹細胞在再生治療、疾病模型及藥物篩選上都有無限潛力,因此蔡老師的研究團隊仍努力的堅持,希望團隊的研究有一天能對人類疾病的治療有所貢獻。在此感謝科技部及臺大深耕計畫的經費贊助,也謝謝許多默默幫助實驗室的前輩們,更謝謝蔡老師研究團隊裡的每個學生們願意為理想而努力地付出!
文章連結:Alternative Splicing Mediated by RNA-Binding Protein RBM24 Facilitates Cardiac Myofibrillogenesis in a Differentiation Stage-Specific Manner
圖片來源:Circulation Research