臺大藥理所楊鎧鍵老師團隊發現擾流機械傳導調控動脈硬化新機制 榮登Science Advances
臺大醫學院藥理所楊鎧鍵副教授研究團隊以基因剔除小鼠及奈米微粒結合CRISPR/Cas9系統,闡明內質網蛋白thioredoxin domain containing 5 (TXNDC5)於內皮細胞受機械傳導調控的新機制,及成為動脈硬化治療目標的潛力。該論文於2022年1月21日刊登於國際頂尖期刊「科學進展」Science Advances。
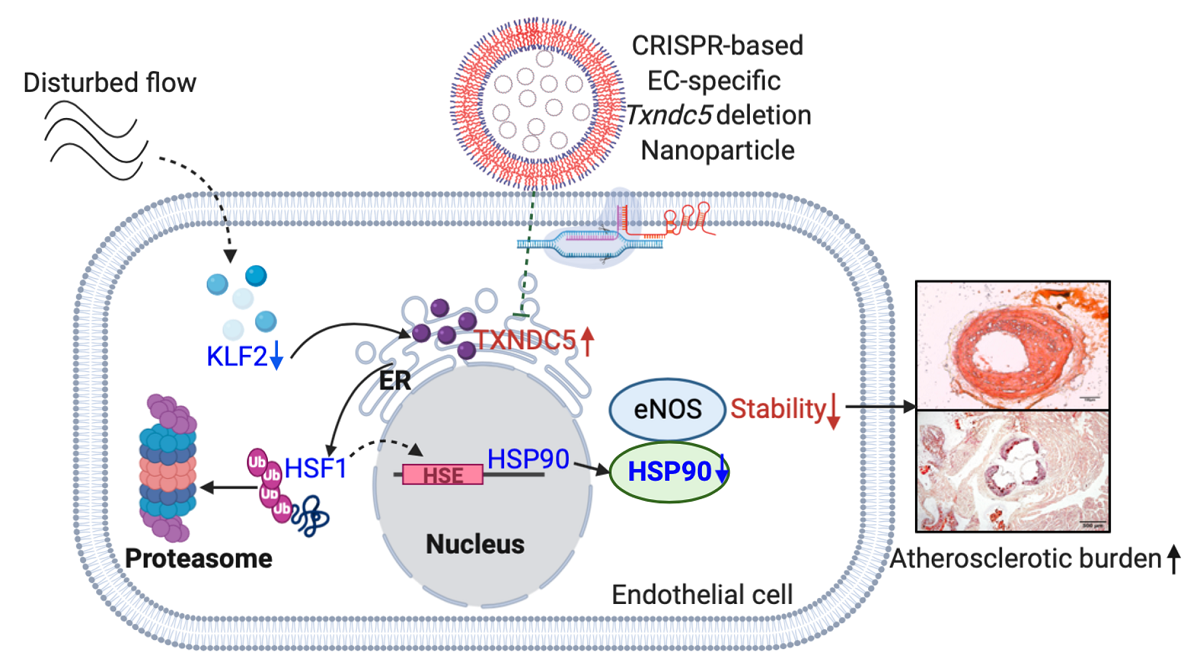
心血管病是國人第二號殺手,其中動脈粥狀硬化是引發心血管病的關鍵因素,目前動脈粥狀硬化的藥物治療主要是針對風險因素的控制,例如糖尿病、高血壓、高血脂等慢性疾病的控制跟治療,而非血管本身。此外,這些治療對於動脈粥狀硬化的改善仍不盡理想。動脈粥狀硬化好發在血管彎曲和分叉的區域,主因是為動脈在彎曲和分叉處會產生擾流(disturbed flow),擾流會刺激內皮細胞,使其功能失調,進而造成動脈粥狀硬化,因此了解擾流如何透過機械傳導性機制 (mechanotransduction mechanism)調控內皮細胞功能十分重要,也可藉此設計出針對內皮中受擾流透過機械傳導調控的蛋白作為新型治療手段。
內質網蛋白TXNDC5是一種蛋白質雙硫異構酶(protein disulfide isomerase,PDI),主要位於細胞的內質網,其功能被認為和催化蛋白摺疊以及參與細胞內氧化還原反應有關。近幾年,楊老師研究團隊研究發現TXNDC5在心臟 (Shih et al, Circulation Research 2018)、肺臟 (Lee et al, Nature Communications 2020)、腎臟(Chen et al, Journal of Clinical Investigation 2021)及肝臟(Hong et al, Gut 2021)纖維化具有不可或缺角色。特別的是,TXNDC5的表現在內皮細胞的表現更為顯著,博士班學生葉志凡醫師進一步發現TXNDC5在血液擾流誘導的內皮細胞功能失調及動脈粥狀硬化形成扮演重要的角色。TXNDC5主要是破壞內皮細胞中endothelial Nitric Oxide Synthase (eNOS)蛋白的穩定性,導致內皮功能的異常,進而造成動脈粥狀硬化的發生。研究團隊在人類及小鼠的動脈粥狀硬化病灶中,發現TXNDC5蛋白表現量較健康動脈組織有顯著上升,為證明TXNDC5與動脈硬化生成的因果關係,研究團隊利用多種基因轉殖小鼠與動脈硬化疾病模式,證明TXNDC5高度表達於受擾流刺激下的血管內皮細胞中,並發現特別剔除小鼠內皮細胞中的TXNDC5,可顯著減少動脈粥狀硬化的發生。研究團隊進一步整合奈米微粒及內皮特異性啟動子(CDH5)驅動的CRISPR/Cas9系統,證明標靶性剔除內皮細胞中的TXNDC5可顯著增加eNOS蛋白的表現並減少ApoE-/-小鼠動脈粥狀硬化的發生,驗證TXNDC5是可作為治療動脈粥狀硬化的標的。
楊老師表示,動脈粥狀硬化會影響全身血管,造成缺血性器官損傷甚至衰竭,是目前高齡化社會沉重的醫療負擔,因此跳脫目前僅對動脈硬化危險因子進行控制的框架,針對內皮細胞及血管功能開發新型藥物為當務之急。近幾年因為COVID-19疫苗的開發以及降血脂藥物的發展,展現出核酸藥物治療的安全性、有效性及持久性,因此未來楊老師實驗室希望能開發靶向內皮細胞中TXNDC5的治療方法,包含基因編輯或是抑制TXNDC5活性的核酸藥物,可望能作為動脈粥狀硬化病患的新型治療。
此研究是多國多實驗室的合作成果,楊老師實驗室的核心研究人員還包含碩士班畢業生鄭世昕、研究助理林瑜珊、博士班畢業生陳彥廷,合作夥伴臺大醫院高憲立教授、林茂欣助理教授、陽明交通大學黃柏勳教授、西班牙卡斯特利翁大學綜合醫院Esther Roselló-Sastre教授、Francisca Garcia教授、埃默里大學Hanjoong Jo教授以及芝加哥大學Yun Fang副教授。
本研究成果已於2022年1月21日發表於Science Advances:
https://www.science.org/doi/10.1126/sciadv.abl8096?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed