李芳仁教授研究團隊首度揭示纖連蛋白誘發小GTP水解酶穩定性 促進細胞遷移
本校分子醫學研究所李芳仁教授的研究團隊日前發表創新論文,首度發現纖連蛋白(fibronectin)能觸發小GTP酶Arf蛋白質家族(small GTPase Arf protein family)中,Arl4A、Arl4D (Arl4A/D) 蛋白質的穩定性而增進細胞遷移能力。此一發現揭示纖連蛋白引導細胞遷移或誘發癌細胞擴散的分子機制。該論文於2022年7月20日刊登於科學領域權威國際期刊「美國國家科學院期刊」(Proceedings of the National Academy of Sciences),受到國際重視。
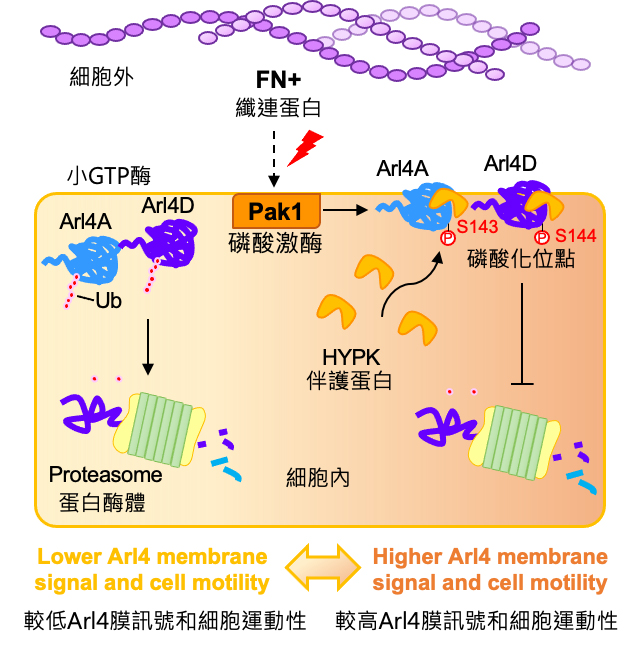
細胞遷移需要細胞內外的分子緊密配合,且在個體發育的每個環節都不可或缺。纖連蛋白(fibronectin)為細胞外基質(extracellular matrix)重要的一員,生理情況下可引導其他細胞外基質,貼附以及細胞浸潤以進行傷口修護,病理情況下則可引導癌細胞集體遷移。貼附於纖連蛋白後的細胞會誘發細胞內訊息傳遞,Pak1 蛋白質磷酸激酶(protein kinase)活化即是一重要指標,此激酶活化後會將眾多下游受質磷酸化,進而促進癌細胞的移動。過去已有眾多評論文獻報導Pak1基因的不正常增生具有高度致癌性,並與在帕金森氏症相關。先前實驗室也發表Arl4A和Pak1之間的反饋調節作用可激活Pak1,並促進細胞遷移。因此,研究細胞外訊息如何調控這些分子運作,將可了解更全面的癌細胞移動機制,並為臨床疾病提供新的研發方向。
李教授實驗室長期以各種癌細胞株來探討於Arl4蛋白質成員,如何與其他蛋白一同調控癌細胞遷移。本篇研究首度發現纖連蛋白影響蛋白質磷酸激酶Pak1的活性,進而磷酸化了Arl4A/D,這樣的磷酸化標記可使蛋白質免於快速降解。另一重大發現是HYPK伴護蛋白(chaperone protein) 與磷酸化後的Arl4A/D親和性提升,能免於泛素化和快速降解,並將之穩固在細胞膜上。本篇研究首度揭示磷酸化可作為伴護蛋白的辨認標記,防止小GTP水解酶快速降解。此一發現也證明小GTP水解酶本身蛋白質的穩定性,對細胞功能的調控比以往認知的更加重要。本篇研究將對於控制Pak1磷酸激酶與小GTP水解酶所引發癌細胞遷移及相關疾病提供嶄新的研究方向。
本研究工作最重要的執行者是博士班學生林明潔,計畫由國家衛生研究院及教育部支持。
本論文於2022年7月20日刊登於科學領域權威國際期刊「美國國家科學院期刊」(Proceedings of the National Academy of Sciences):https://doi.org/10.1073/pnas.2207414119