分醫所徐立中教授發現第三型類鐸受體引發干擾素產生以及病毒引起的呼吸道細菌雙重感染的調控機制 榮登免疫醫學頂尖期刊 Journal of Experimental Medicine
醫學院分子醫學研究所教授徐立中研究團隊日前發表論文,首度揭示ZNRF1泛素連接酶(ubiquitin ligase)調控第三型類鐸受體(TLR3)介導的免疫反應,此新發現對病毒引起呼吸道細菌雙重感染(Respiratory bacterial superinfections)的患者在藥物開發上的治療策略提供新方向。該論文於2023年8月7日刊登於國際知名期刊「實驗醫學雜誌」(Journal of Experimental Medicine)。
第一型干擾素(Type I interferon)在哺乳類動物抗病毒過程中扮演著主要的細胞激素角色,然而,持續的產生干擾素對宿主個體可能造成損害,容易導致自體免疫疾病(autoimmune disease)或者病毒引發細菌雙重感染的風險。第三型類鐸受體Toll-like receptor 3 (TLR3)驅動第一型干擾素免疫反應,對於哺乳類動物對抗特定RNA病毒(例如新型冠狀病毒(SARS-CoV2)和腦心肌炎病毒(Encephalomyocarditis virus)至關重要。雖然很多研究已經清楚解析宿主細胞如何啟動TLR3引發免疫反應,但調控終止TLR3介導的訊息傳遞機制仍然尚未完全了解。
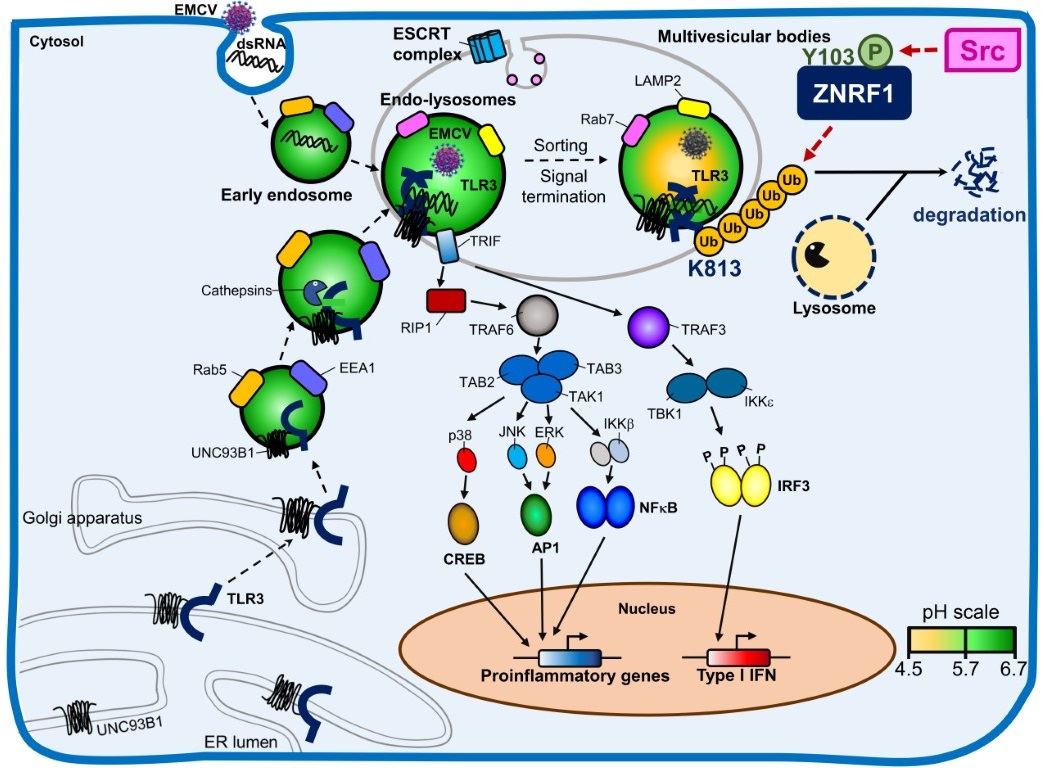
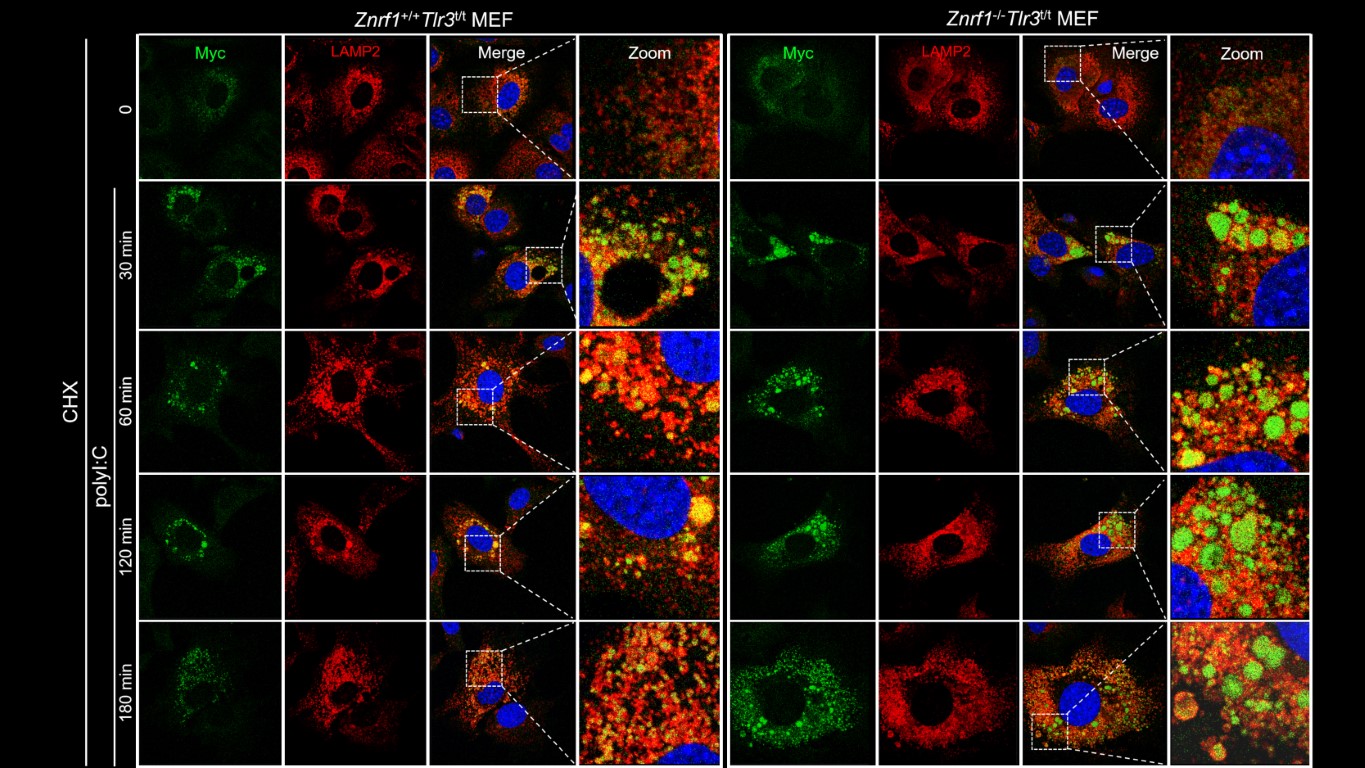
徐教授長期投入研究先天性免疫細胞中訊息傳遞和發炎反應的調控。實驗室博士生林祐聖的研究發現,泛素連接酶ZNRF1對TLR3胞內體(endosomes)起著關鍵作用,它導致TLR3進入多囊體(multivesicular bodies)和溶酶體(lysosomes),進而降解TLR3蛋白質,使其關閉TLR3訊號傳遞,降低第一型干擾素的產生。在分子層面上,當TLR3被活化時,c-Src激酶磷酸化ZNRF1第103位點的酪胺酸,促使ZNRF1在TLR3第813位點的離胺酸形成K63鏈結的泛素化,使TLR3從胞內體運輸至溶酶體,最終導致TLR3的降解,而終止TLR3介導的免疫反應。
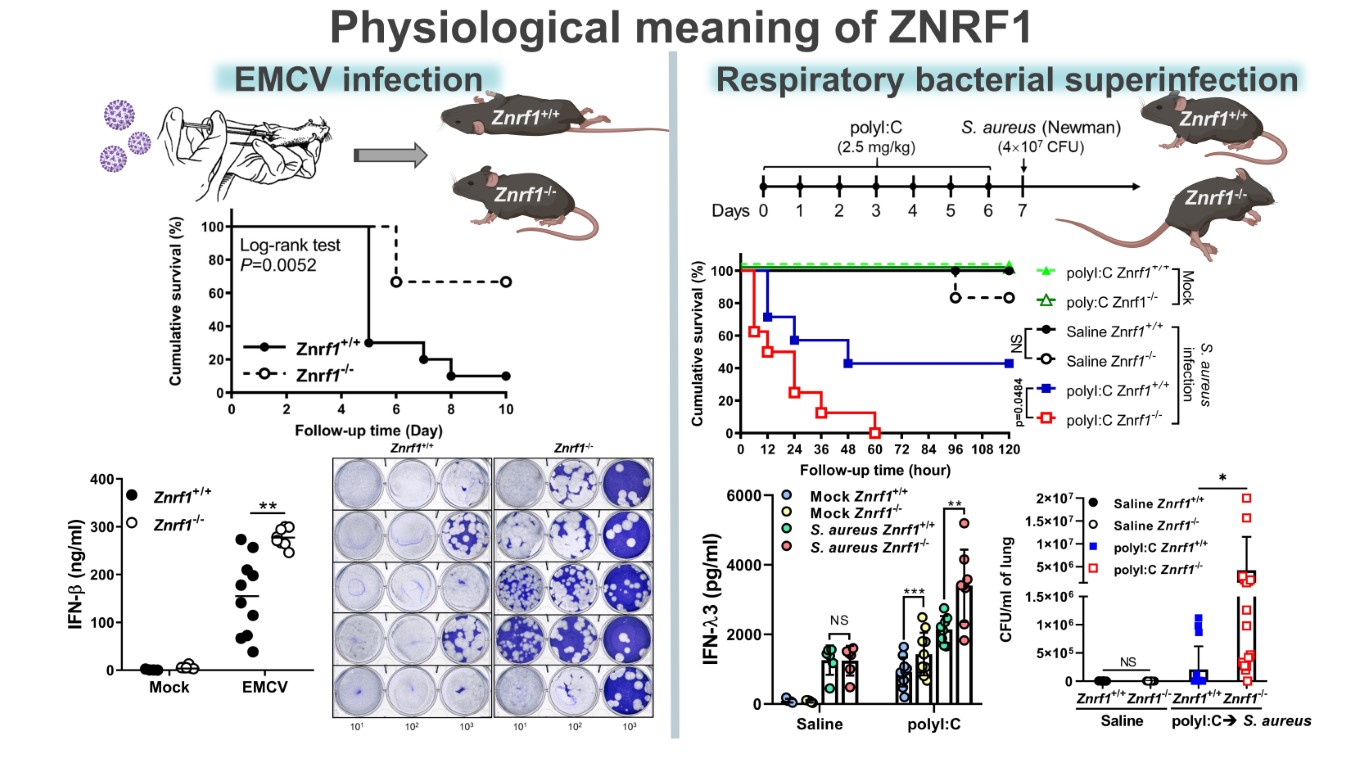
從生理的角度來看,研究團隊發現,在ZNRF1缺失的小鼠和細胞中,由於第一型干擾素的產生增強,這些生物體能夠更有效地抵抗腦心肌炎病毒和新型冠狀病毒的感染。然而,缺乏ZNRF1的小鼠更容易受到病毒引起的呼吸道感染,進而導致細菌雙重感染(respiratory bacterial superinfection),加劇肺部屏障的損傷。綜觀來說,徐立中老師團隊的研究強調c-Src-ZNRF1此一路徑作為負向回饋機制,用來調控TLR3運輸並終止TLR3介導的訊息傳遞。研究確認在抗病毒免疫反應中,ZNRF1扮演調控角色,對於TLR3介導的訊號和第一型干擾素的產生具有負向調節作用,能夠避免過度的發炎反應,並減少病毒引起呼吸道細菌雙重感染的風險。
徐立中老師表示,這項研究延續他在2017年發表於Nature Communications的研究,當時他探討ZNRF1對TLR4介導的免疫反應調控的議題。在實驗過程中,意外地發現ZNRF1也參與胞內體成員TLR3的信號傳遞,因此開啟此項研究的進行,過程中歷經SARS-CoV2肆虐全球,也促使投入SARS-CoV2的研究,但當時同時面臨實驗室人員分流,材料短缺,費時6年多才完成此研究。
此篇論文除了第一作者為徐老師的博士班指導學生,其他作者包含張詠淇博士生,何育信碩士生,李志元醫師、賴亭諭博士,張淑媛教授、薛一蘋教授、莊宗顯教授。感謝臺大、國家衛生研究院及行政院科技部對此研究的支持和協助,團隊目前也將持續投入ZNRF1對於免疫反應相關系列的研究。
該論文刊登於Journal of Experimental Medicine:https://rupress.org/jem/article/220/8/e20220727/214096/The-Src-ZNRF1-axis-controls-TLR3-trafficking-and
徐立中老師實驗室連結:http://molecular.ntu.edu.tw/Teacher/Faculty_more?Id=4&type=1