Arl4A可調控癌細胞 中表皮生長因子受體(EGFR)之降解
臺大醫學院分子醫學研究所教授李芳仁團隊日前發表重要研究成果,揭示小GTP酶Arl4A調控蛋白質受體運輸至溶酶體(lysosome)降解的新穎機制,並証明Arl4A的表現是維持表皮生長因子(EGF)受體EGFR不被快速降解的分子機轉之一。該論文於2023年11月29日刊登於《自然通訊》Nature Communications卓越期刊,受到國際重視。
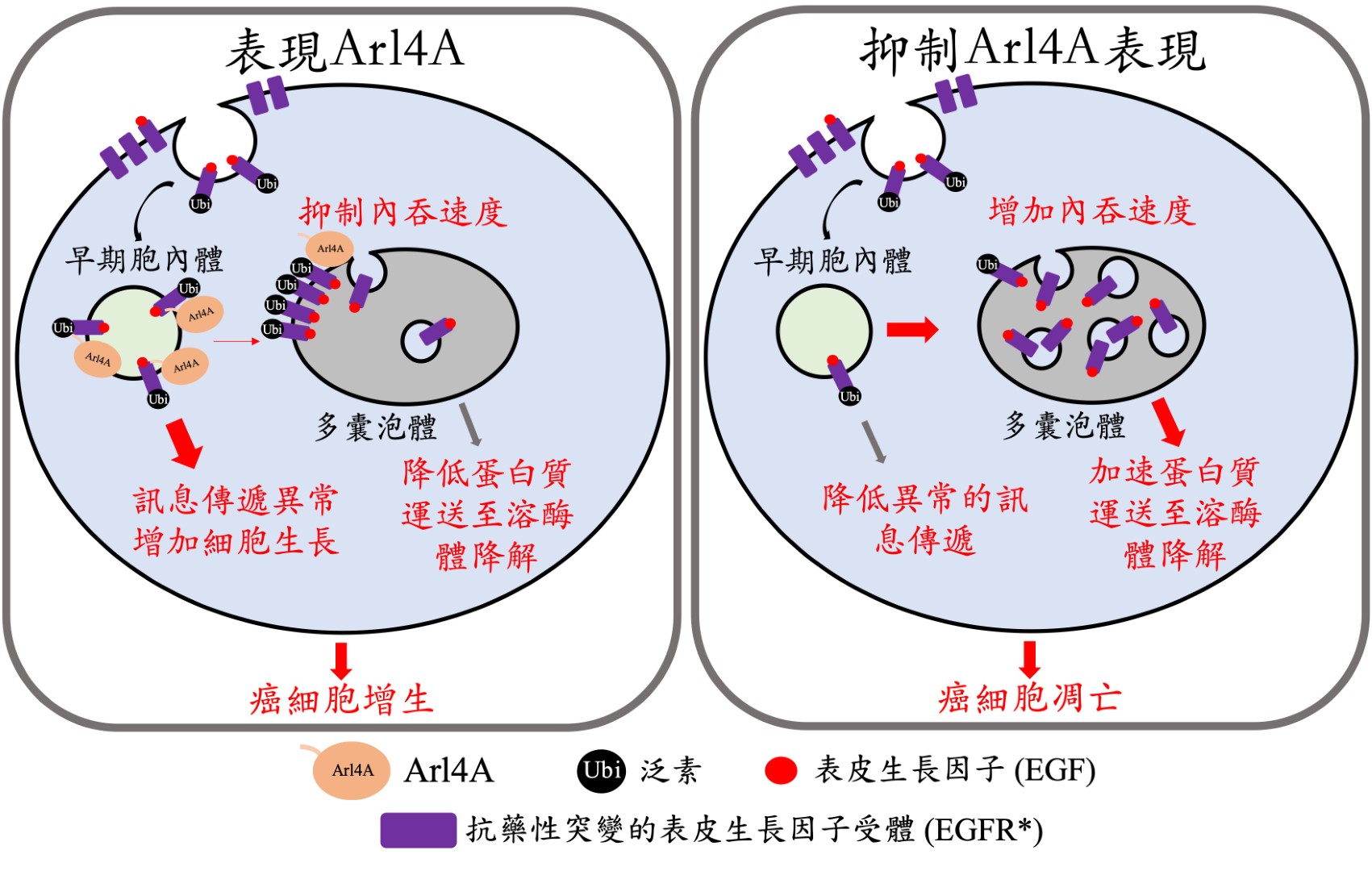
肺癌向來是極具危險性的疾病。其中,EGFR基因突變所導致的肺癌尤其常見。正常的EGFR是刺激細胞增生的重要接受器,接受到EGF刺激後會被內吞入細胞內,在去除泛素(ubiquitin)的標記後,最終藉由多囊泡體(MVB)跟溶酶體的結合而降解掉,以嚴格控制細胞的增生而不致癌化。而在肺癌中的EGFR突變體因為變得難以被細胞降解,促使細胞不斷傳遞增生的訊號而形成癌症。近年來,雖然有標靶治療藥物可抑制EGFR,但抗藥性問題已逐漸浮現,需要更了解EGFR的調控機制才能開創其他治療方向。
李芳仁教授團隊經過多年的研究,首次發現Arl4A在細胞內扮演著抑制EGFR降解的角色。Arl4A可以與ESCRT-II複合物中的蛋白質VPS36結合,使得EGFR上的泛素標記無法去除,無法去除泛素的EGFR進入多囊泡體受阻,而無法有效率地被溶酶體降解。重點是,若抑制細胞內Arl4A與VPS36的結合,EGFR和EGFR突變體皆可因此快速送入溶酶體進行降解,導致癌細胞更容易進入凋亡(apoptosis)狀態。此外,抑制Arl4A表現還會增加以EGFR為標的的抗癌藥物(Gefitinib)的敏感性,從而提高藥物的毒殺效應。未來如能發現Arl4A的抑制劑,可望對EGFR有突變和降解抗性的肺癌種類,提供治療的新方向。
此篇研究首度揭示Arl4A調控EGFR降解的分子機制,為癌症治療提供嶄新的研究方向與希望。李教授的團隊將繼續研究Arl4A調控細胞囊泡運輸的分子機制,期待能為臨床疾病的治療貢獻新的線索。
感謝國家衛生研究院及教育部支持對此項研究計畫支持。